ऊष्मा Heat
ऊष्मा उर्जा का एक रूप होता है, जिसके कारण हमें गर्माहट का अनुभव होता है, कोई वस्तु कितनी गरम है, इसका मापन एक विशेष पैमाने के अनुसार किया जाता है और यह माप तापमान (Temperature) कहलाता है। ऊष्मा वह उर्जा है जिसके कारण तापमान उत्पन्न होता है। विभिन्न तापमान वाली दो वस्तुओं को परस्पर मिला देने पर ऊष्मा उर्जा अधिक तापमान वाली वस्तु से निकलकर कम तापमान वाली वस्तु मेँ प्रवाहित होती है। अतः तापमान वह राशि है जो ऊष्मा के प्रवाह की दिशा निर्धारित करता है। तापमान नापने का उपकरण थर्मामीटर होता है।
प्रत्येक वस्तु को गर्म करने के लिए ऊष्मा ऊर्जा देनी पडती है और गर्म वस्तु जब ठंडी होती है तो ऊष्मा उर्जा निकलती है। किसी पदार्थ के एक किलोग्राम द्रव्यमान का तापमान 1°C तक बढ़ाने के लिए आवश्यक ऊष्मा ऊर्जा की मात्रा को उस पदार्थ की विशिष्ट ऊष्मा कहा जाता है।
ऊष्मा ऊर्जा की माप कैलोरी या किलोकैलोरी मेँ की जाती है। 1 ग्राम जल का तापमान 1°C तक बढ़ाने के लिए आवश्यक ऊष्मा 1 कैलोरी होती है। एक कैलोरी ऊष्मा उर्जा लगभग 4.2 जूल कार्य कर सकती है। अतः आजकल उष्मा ऊर्जा को जूल मेँ व्यक्त किया जाता है, क्योंकि ऊर्जा का मात्रक जूल ही होता है।
जब किसी को ठोस पदार्थ को द्रव अवस्था मेँ अथवा द्रव से गैस अवस्था मेँ बदलना हो तो उसे ऊष्मा की आवश्यकता होती है। यह अतिरिक्त ऊष्मा केवल अवस्था परिवर्तन के लिए प्रयुक्त होती है, उसका ताप नहीँ बढ़ता है। प्रति किलोग्राम पदार्थ के लिए आवश्यक ऊष्मा की अतिरिक्त मात्रा उस पदार्थ की गुप्त ऊष्मा (Latent Heat) कहलाती है। गैस से द्रव अथवा दाव से ठोस में परिवर्तित होते समय ही यही गुप्त ऊष्मा, पदार्थ द्वारा त्याग दी जाती है।
द्रव पदार्थ पर प्रत्येक ताप धीरे-धीरे वाष्प मेँ परिवर्तित होते रहते हैं। यह क्रिया वाष्पन (Evaporation) कहलाती है। वाष्पन के लिए आवश्यक ऊष्मा ऊर्जा उसी पदार्थ मेँ से तथा उसके आसपास के वातावरण से प्राप्त होती है, अतः वाष्पन के कारण ताप मेँ कमी होती है।
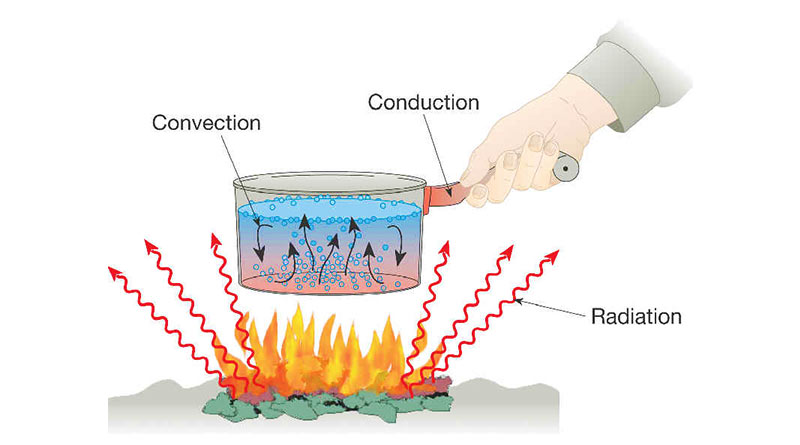
ऊष्मा का एक स्थान से दूसरे स्थान को संचरण तीन विधियों से होता है- चालन (Conduction), संवहन (Convection) तथा विकिरण (Radiation)।
चालन Conduction
चालन, ऊर्जा संचालन की वह प्रक्रिया है, जिसमेँ द्रव्य (Matter) के अणु ऊष्मा को एक स्थान से दूसरे स्थान तक पहुंचा देते हैं, परंतु उसके अणु स्वयं अपना स्थान छोड़कर दूसरे स्थान पर नहीँ जाते। उदाहरण- लोहे की छड़ को आग मेँ डालने पर लोहे का एक अणु गर्म होता है फिर दूसरा और तीसरा, इस प्रकार अणु क्रमशः गर्म होते होते ऊष्मा छड़ के हाथ वाले सिरे तक पहुंच जाती है।
संवहन Convection
इस विधि से तरल पदार्थ गर्म होता है। जब किसी की तरल पदार्थ (द्रव अथवा गैस) मेँ किसी एक स्थान का ताप दूसरे स्थान की अपेक्षा ऊँचा हो जाता है तो उसका स्थान पर पदार्थ का घनत्व दूसरे स्थान की अपेक्षा कम हो जाता है। अतः पदार्थ के ऊंचे तापमान वाले को ऊपर उठने लगते हैं तथा उनका स्थान नीचे तापमान वाले कण लेने लगते हैं। यह प्रक्रिया तब तक चलती रहती है जब तक कि संपूर्ण पदार्थ एक ही ताप पर नहीँ आ जाता। ऊष्मा संचरण की इस प्रक्रिया को जिसमे पदार्थ के कण स्थानांतरित होते हैं, संवहन कहते हैं।
ठोसों मेँ (तथा पारे मेँ) ऊष्मा का संचरण केवल चालन द्वारा ही होता है, जबकि द्रवों व गैसो मेँ यह मुख्यतः संवहन द्वारा होता है (परन्तु द्रवों व गैसों में यह चालन द्वारा भी संभव है)
विकिरण Radiation
किसी गर्म स्रोत से ऊष्मा (ऊर्जा) विद्युत चुंबकीय तरंग के रुप मेँ संचारित होती है, इसे विकिरण कहते हैं इसके लिए माध्यम की आवश्यकता नहीँ होती (यदि बीच मेँ कोई माध्यम भी हो तो वह गर्म नहीँ होगा)। सूर्य से पृथ्वी पर उष्मा विकिरण द्वारा ही पहुंचती है।
चालन और संवहन द्वारा उष्मा संचरण धीरे-धीरे होता है, परन्तु विकिरण द्वारा उष्मा प्रकाश की चाल से संचरितत होती है। इसके अतिरिक्त चालन और संवहन मेँ उष्मा का संचरण का मार्ग ठेढ़ा-मेढ़ा हो सकता है, परंतु विकिरण का मार्ग सरल रेखा ही होता है। यही कारण है कि धुप मेँ छाता लगाकर सूर्य की ऊष्मा से बचा जा सकता है। इस तरह प्रकाश की भांति उष्मीय विकिरण भी विद्युत चुंबकीय तरंगें हैं।
उष्मीय विकिरण के गुण
1. प्रकाश की भांति उष्मीय विकिरण भी सरल रेखा मेँ चलता है।
2. प्रकाश के वेग के बराबर ही उष्मीय विकिरण का वेग 3×108 मी./से. से होता है।
3. उष्मीय विकिरण प्रकाश की भांति परावर्तन के नियमों का पालन करता है।
4. उष्मीय विकिरण निर्वात मेँ होकर चलता है।
5. उष्मीय विकिरण में भी प्रकाश की भांति अपवर्तन की क्रिया होती है।
6. प्रकाश के प्रदीप्त घनत्व की भांति, उष्मीय विकिरण की तीव्रता भी स्रोत और बिंदु के बीच की दूरी के वर्ग के व्युत्क्रमानुपाती होती है।
ताप के भिन्न भिन्न पैमाने Different Scales of Temperature
सेंटीग्रेट अथवा सेल्सियस पैमाना Centigrade or Celsius Scale- इसे स्वीडन के वैज्ञानिक सेल्सियस ने सन 1742 मेँ बनाया था, जिसमेँ एक वायुमंडलीय दाब (0.76 मी. पारे का स्तंभ) पर हिमांक को 0° तथा क्वथनांक को 100° मानकर को बीच के अंतर को 100 बराबर भागों में विभाजित कर दिया जाता है।
प्रत्येक भाग को 1°C कहते हैं। 0°C के नीचे तथा 100°C के ऊपर भी चिन्हित करके पैमाने को बड़ा किया जा सकता है।
फारेनहाइट पैमाना Fahrenheit Scale
इसे जर्मनी के प्रसिद्द वैज्ञानिक फारेनहाइट ने सन 1710 में बनाया था। इसमें पानी के हिमांक को 32° तथा क्वथनांक को 212° चिन्हित करके बीच के अंतर को 180 समान भागों में बंटा गया है। प्रत्येक भाग को 1°F कहते हैं।
केल्विन पैमाना या परम पैमाना Kelvin Or Absolute Scale
आदर्श गैसों के उष्मीय प्रसार के अधर पर इस पैमाने की परिकल्पना लार्ड केल्विन ने की थी। इसमें पानी के हिमांक को 273K तथा क्वथनांक को 373K मानकर इसके बीच के अंतर को 100 समान भागों में विभाजित कर दिया जाता है। प्रत्येक भाग को 1K (केल्विन) कहते हैं।
इस तापमापी की विशेषता यह है कि इसका शून्य ताप 0K द्रव्य के लिए न्यूनतम संभव ताप है, क्योंकि इस ताप पर अणुओं की प्रत्येक प्रकार की गति सिद्धान्तः समाप्त हो जाति है। इस ताप को परमशून्य ताप (Absolute Zero) भी कहते हैं।
सेल्सियस तथा केल्विन के मापों में सम्बन्ध
1°C ताप का अंतर 1K के तापान्तर के बराबर होता है। जब सेल्सियस वाले पाठ को केल्विन में बदलना होता है, तो उसमें 273 जोड़ देता हैं, इसके विपरीत यदि केल्विन को सेल्सियस में बदलना होता है, तो केल्विन में से 273 घटा देते हैं।
सेल्सियस तथा फारेनहाइट के मापों में सम्बन्ध- सेल्सियस पैमाने के 100 भाग, फारेनहाइट के 180 भागों के बराबर होता है। इस प्रकार सेल्सियस का एक भाग, फारेनहाइट के 180/100 भाग या 9/5 भाग के बराबर होता है। सेल्सियस में हिमांक 0° होता है तथा फारेनहाइट में 32° होता है।
अतः F=9/5C+32 या F – 32/9=C/5