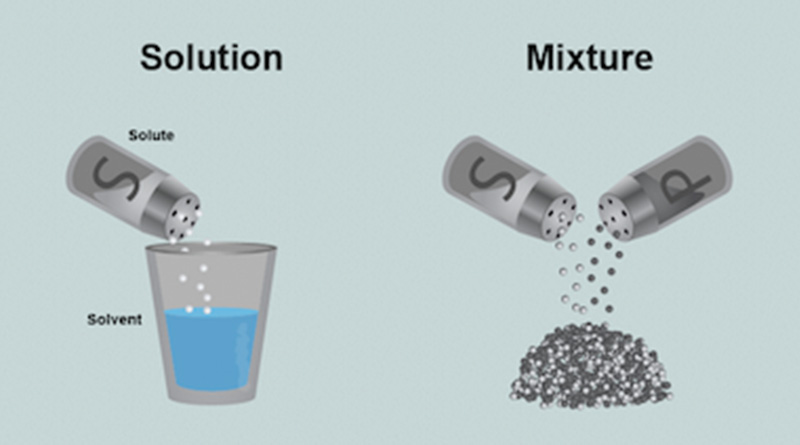
विलयन Solution
विलयन दो या दो से अधिक पदार्थों का एक समांग मिश्रण है, जिसमें किसी निश्चित ताप पर विलेय और विलायक की आपेक्षिक मात्राएँ एक निश्चित सीमा तक निरंतर परिवर्तित हो सकती हैं।
उदाहरण- नमक का जल में विलयन, चीनी का जल में विलयन आदि।
विलयन की विशेषताएं Characteristics of Solution
- विलयन दो या दो से अधिक पदार्थों का समांग मिश्रण है।
- किसी विलयन में विलेय के कणों की त्रिज्या 10-7 सेमी से कम होती है। अत: इन कणों को सूक्ष्मदर्शी द्वारा भी नहीं देखा जा सकता है।
- विलयन में विलेय के कण विलायक में इस प्रकार घुलमिल जाते हैं कि एक का दूसरे से विभेद करना संभव नहीं होता है।
- विलयन में उपस्थित विलेय के कण छन्ना पत्र के आर-पार आ जा सकते हैं।
- विलयन स्थायी एवं पारदर्शक होता है।
विलेय और विलायक Solute and Solvent
विलयन में जो पदार्थ अपेक्षाकृत अधिक मात्रा में होता है, उसे विलायक कहते हैं, तथा जो पदार्थ कम मात्रा में उपस्थित रहता है, उसे विलेय कहते हैं। जिस विलायक का डाइइलेक्ट्रिक नियतांक जितना अधिक होता है, वह उतना ही अच्छा विलायक माना जाता है। जल का डाइइलेक्ट्रिक नियतांक का मान अधिक होने के कारण इसे सार्वत्रिक विलायक (Universal solvent) कहा जाता है।
विलायकों के उपयोग
- औषधि उद्योग में अनेक औषधियों के निर्माण में,
- निर्जल धुलाई में (बेंजीन व पेट्रोल जैसे विलायकों का),
- इत्र निर्माण में,
- रंग, रोगन को घोलने में,
- अनेक प्रकार के पेय व खाद्य पदार्थों के निर्माण में आदि।
| विलयनों का वर्गीकरण | |
| विलयनों के प्रकार | उदाहरण |
| 1. गैस में गैस का विलयन | वायु, गैसों का मिश्रण |
| 2. गैस में द्रव का विलयन | ब्रोमीन, कार्बन डाइऑक्साइड, अमोनिया आदि गैसों का जल में विलयन, बादल, कुहरा आदि। |
| 3. गैस में ठोस का विलयन | वायु में आयोडीन का विलयन, धुआँ आदि। |
| 4. द्रव में गैस का विलयन | जल में कार्बन डाइऑक्साइड का विलयन, बेजीन में हाइड्रोजन क्लोराइड गैस का विलयन आदि। |
| 5. द्रव में द्रव का विलयन | जल में ऐल्कोहॉल का विलयन, कार्बन डाइसल्फाइड में ब्रोमीन का विलयन, सल्फ्यूरिक अम्ल का जल में विलयन आदि। |
| 6. द्रव में ठोस का विलयन | जल में चीनी का विलयन, कार्बन टेट्राक्लोराइड में आयोडीन का विलयन, पारा में लेड का विलयन, जेली, स्टार्च, प्रोटीन, सॉल आदि। |
| 7. ठोस में गैस का विलयन | पैलेडियम धातु में हाइड्रोजन का विलयन, कपूर का वायु में विलयन आदि। |
| 8. ठोस में द्रव का विलयन | थैलियम में पारा का विलयन, चीनी में जल का विलयन, नमक में जल का विलयन आदि। |
| 9. ठोस में ठोस का विलयन | ताँबा में जस्ता, ताँबा में टिन, ताँबा में ऐलुमिनियम, ताँबा में जिंक व निकेल आदि का विलयन (मिश्रधातुएँ) |
संतृप्त, असंतृप्त तथा अतिसंतृप्त विलयन Saturated, Unsaturated and Super Saturated Solution
किसी निश्चित ताप पर बना एक ऐसा विलयन जिसमें विलेय पदार्थ की अधिकतम मात्रा घुली हुई हो, संतृप्त विलयन कहलाता है।
किसी निश्चित ताप पर बना ऐसा विलयन जिसमें विलेय पदार्थ की और अधिक मात्रा उस ताप पर घुलाई जा सकती है, असंतृप्त विलयन कहलाता है।
ऐसा संतृप्त विलयन जिसमें विलेय की मात्रा उस विलयन को संतृप्त करने के लिए आवश्यक विलेय की मात्रा से अधिक घुली हुई हो, अतिसंतृप्त विलयन कहलाता है।
विलेयता Solubility
किसी निश्चित ताप और दाब पर 100 ग्राम विलायक में घुलने वाली विलेय की अधिकतम मात्रा को उस विलेय पदार्थ की उस विलायक में विलेयता कहते हैं।
यदि t° C पर W ग्राम जल में किसी विलेय पदार्थ के अधिक से अधिक w ग्राम घुले हुए हों, तो उस ताप पर उस विलेय की जल में विलेयता [latex]=\frac { w\quad \times \quad 100 }{ W }[/latex]
विलेयता पर ताप का प्रभाव
- सामान्यतः ठोस पदार्थों की विलेयता ताप बढ़ाने से बढ़ती है। लेकिन कुछ ऐसे भी ठोस पदार्थ हैं, जिनकी विलेयता ताप बढ़ाने से घटती है। जैसे- सोडियम सल्फेट, कैल्सियम हाइड्रॉक्साइड, कैल्सियम साइट्रेट आदि।
- किसी द्रव में गैस की विलेयता ताप बढ़ने से घटती है।
विलेयता संबंधी प्रमुख तथ्य
- अधुवीय पदार्थ अधुवीय विलायकों में प्रायः विलेय होते हैं। उदाहरणार्थ- ब्रोमीन का कार्बन टेट्राक्लोराइड में घुलना।
- अधुवीय पदार्थ ध्रुवीय विलायकों में प्रायः अधिक विलेय नहीं होते हैं। उदाहरणार्थ- कार्बन टेट्राक्लोराइड जल में बहुत ही कम विलेय होते हैं।
- ध्रुवीय पदार्थ धुवीय विलायकों में प्रायः विलेय होते हैं। उदाहरणार्थ- इथाइल ऐल्कोहॉल जल में काफी विलेय होता है। (d) ध्रुवीय पदार्थ अधुवीय विलायकों में अधिक विलेय नहीं होते हैं। उदाहरणार्थ- सोडियम – क्लोराइड कार्बन टेट्राक्लोराइड में अल्प विलेय होता है।
- अणुभार में वृद्धि होने से पदार्थों की विलेयता घटती जाती है। उदाहरणार्थ- मिथाइल ऐल्कोहॉल (अणुभार = 32) की तुलना में ब्यूटाइल ऐल्कोहॉल (अणुभार = 74) जल में बहुत कम विलेय है।
विलयन का सांद्रण Concentration of Solution
किसी विलायक या विलयन की इकाई मात्रा में उपस्थित विलेय की मात्रा को विलयन का सांद्रण कहते हैं। जिस विलयन में विलेय की पर्याप्त मात्रा घुली रहती है, उसे सांद्र विलयन (Concentrated solution) कहा जाता है तथा जिस विलयन में विलेय की कम मात्रा घुली रहती है, उसे तनु विलयन (Dilute Solution) कहा जाता है। सभी तनु विलयन असंतृप्त विलयन होते हैं, जो विलयन जितना ही अधिक तनु होता है वह उतना ही अधिक असंतृप्त होता है।
परिक्षेपण, निलम्बन, कोलॉइड एवं वास्तविक विलयन
परिक्षेपण Dispersion
जब किसी पदार्थ के कण (अणु, परमाणु या आयन) दूसरे पदार्थ के कणों के इर्द-गिर्द छितरा दिये जाते हैं, तो यह क्रिया परिक्षेपण कहलाती है। पहले पदार्थ को परिक्षेपित पदार्थ (Dispersed substance) और दूसरे को परिक्षेपण माध्यम (Dispersion Medium) कहा जाता है।
परिक्षेपण के परिणामस्वरूप दो प्रकार के पदार्थों का निर्माण होता है-
- विषमांग पदार्थ (Heterogeneous Substance), जैसे- निलम्बन, कोलॉइड और
- समांग पदार्थ (Homogeneous substance), जैसे- वास्तविक विलयन।
निलम्बन, कोलॉइड और वास्तविक विलयन में परिक्षेपित कणों (Dispersed Partictes) के आकार भिन्न-भिन्न होते हैं।
निलम्बन Suspension
छोटे आकार के कणों के पदार्थ जो विलायक में अघुलनशील, परन्तु नग्न आँखों से दृश्य होते हैं, निलम्बन देते हैं।
- यह दो या दो से अधिक पदार्थों का विषमांग मिश्रण है।
- इसमें परिक्षेपित कणों का आकार 10-5 सेमी या इससे अधिक होता है।
- इसके कण छन्ना पत्र के आर-पार नहीं आ-जा सकते हैं।
- परिक्षेपित कणों को नग्न आँखों से देखा जा सकता है।
- ये अस्थायी होते हैं तथा इनके कणों में परिक्षेपित माध्यम से अलग हो जाने की प्रवृत्ति पायी जाती है।
उदाहरण- नदी का गंदा जल, वायु में धुआँ आदि।
कोलॉइड Colloid
- यह दो पदार्थों का विषमांग मिश्रण होता है।
- इसमें परिक्षेपित कणों (Dispersed Particles) का आकार 10-5 सेमी और 10-7 सेमी के बीच होता है।
- इसके कणों को नग्न आँखों से नहीं देखा जा सकता, बल्कि इन्हें अति सूक्ष्मदर्शी (Ultra Microscope) की सहायता से ही देखा जा सकता है।
- इसके कण छन्ना पत्र के आर-पार आ-जा सकते हैं।
- यह स्थायी होता है। स्थिर छोड़ देने पर इसके कणों में परिक्षेपण माध्यम से अलग हो जाने की बहुत कम प्रवृत्ति पायी जाती है।
उदाहरण- दूध, गोंद, रक्त, स्याही आदि।
वास्तविक विलयन True Solution
- यह दो या दो से अधिक पदार्थों का समांग मिश्रण है।
- इसमें कण आण्विक आकार वाले होते हैं, अर्थात् इनके कणों का आकार 10-8 सेमी होता है।
- इसके कण परिक्षेपण माध्यम के साथ इस प्रकार घुलमिल जाते हैं कि दोनों में विभेद कर पाना अत्यंत कठिन होता है।
- इसके परिक्षेपित कण छन्ना पत्र के आर-पार आसानी से आ-जा सकते हैं।
- यह सबसे अधिक स्थायी तथा पारदर्शक होता है।
उदाहरण- चीनी का जल में विलयन, नमक का जल में विलयन आदि।
उदासीन, अम्लीय तथा क्षारीय विलयन Neutral, Acidic and Alkaline Solution
- ऐसा विलयन जिसमें हाइड्रोजन आयनों (H+) और हाइड्रॉक्साइड आयनों (OH–) का सांद्रण समान होता है, उदासीन विलयन कहलाता है।
- ऐसा विलयन जिसमें हाइड्रोजन आयनों (H+) का सांद्रण हाइड्रॉक्साइड आयनों (OH–) से अधिक होता है, अम्लीय विलयन कहलाता है।
- ऐसा विलयन जिसमें हाइड्रॉक्साइड आयनों (OH–) का सांद्रण हाइड्रोजन आयनों (H+) से अधिक होता है, क्षारीय विलयन कहलाता है।